Sobat, ketika kita belajar teori kinetika gas di bangku SMA ada yang namanya gas ideal (ideal gas). Apa pengertian gas ideal? Hukum apa saja yang berlaku? Aturan atau rumus apa saja yang terlibat di dalamnya? Gas ideal sama seperti sobat punya sebuah bejana kecil tertutup berisi bola-bola yang sangat kecil. Bola-bola kecil tersebut bergerak super aktif ke segala arah, acak, saling berbenturan (lenting sempurna), dan tidak ada gaya tarik menarik satu sama lain. Buat lebih jelasnya dan memudahkan sobat hitung yang duduk di SMA, berikut cerita tentang gas ideal, rumus dan serba serbinya.
Apa itu Gas Ideal?
Sama halnya calon istri atau suami ideal yang punya banyak kriteria atau asumsi macam-macam yang berbeda untuk masing-masing sobat hitung, gas ideal juga demikian. Akan tetapi yang membedakannya adalah kriteria atau asumsi suatu gas dianggap ideal sudah ditetapkan sama oleh para ilmuwan. Definis gas ideal adalah gas yang memenuhi kriteria atau asumsi sebagai berikut:
| 1. Gas ideal adalah gas yang terdiri dari partikel-partikel kecil baik atom maupun molekul dalam jumlah yang sangat banyak. | 2. Ukuran dari partikel gas dapat diabaikan terhadap ukuran wadahnya |
| 3. Setiap (every) partikel gas bergerak random (acak) ke segala arah | 4. Gaya tarik Menarik antar partikel gas dianggap tidak ada |
| 5. Persebaran partikel gas merata di dalam wadaah | 6. Setiap tumbukan yang terjadi adalah tumbukan lenting sempurna |
| 7. Partikel gas memenuhi hukum newton tentang gerak |
Tekanan Pada Gas Ideal
Tekanan gas ideal berlaku hukum boyle yang menyatakan baha pada jumlah mol dan sushu tetap, volume akan berbanding terbalik dengan tekanan gas. Persamaan tekanan gas ideal dirumuskan sebagai berikut :
N = banyaknya partikel gas = 6,02 x 1023
m = massa dari 1 partikel gas (Kg)
v = kecepatan gerak partikel gas (m/s)
V = volume gas (m3)
P = tekanan gas ideal (N/m2)
oleh karena kita tahu bahwa energi kinetik dirumuskan Ek = ½ mv2 maka persamaan di atas dapat diubah menjadi
dengan Ek = Energi kinetik gas (satuan joule).
Persamaan Gas Ideal
Dalam gas ideal berlaku 3 hukum tentang kinetika gas yaitu
Hukum Boyle : V ∝ 1/P (n dan T tetap)Hukum Charles : V ∝ T ( n dan P konstan)Hukum Avogadro V ∝ n ( P dan T tetap)
Dari ketiga hukum di atas, dapat dikatakan volume gas berbanding langsung terhadap jumlah gas dan suhu dan berbanding terbalik terhadap tekanan, dirumuskan persamaang gas ideal
atau
N = jumlah partikel gas
n = jumlah mol gas
R = tetapan gas umum 8,31 x 103 M/mol K
k = tetapan Boltzman = 1,38 x 10-23 J/K
untuk menentukan jumlah mol gas (n) sobat dapat menggunakan 2 alternatif rumus berikut
atau
No = bilangan avogadro 6,02 x 1023
Mr = massa molekul relatif gas
m = masa partikel gas
Energi dalam Gas Ideal
Satu partikel gas ideal selalu bergerak dengan energi kinetik
Besarnya energi kinetik untuk N buah partikel dinyatakan dengan rumus
atau
dalam has ideal hanya terdapat energi kinetik, tidak ada energi yang lain sehingga energi kinetik yang ada di gas ideal juga merupakan energi dalam yang dimiliki oleh gas ideal (U). Besarnya energi dalam dibedakan menjadi dua yaitu monoatomik dan diaatomik.
Energi dalam gas monoatomik
Energi dalam gas diatomik
- pada suhu rendah (+/- 300 K) U = 3/2 N kT
- pada suhu sedang (+/- 500 K) U = 5/2 N kT
- pada suhu tinggi (+/- 1000 K) U = 7/2 N kT
Kecepatan Gerak Partikel
untuk menentukan besarnya kecepatan gerak dari partikel di dalam gas ideal sobat bisa mencarinya dari rumus energi kinetik pada gas ideal.
Ek = 3/2 N kT
1/2 m v2 = 3/2 N kT
v2 = 3 kT/m
dengan demikian, kecepatan partikel gas ideal dapat ditentukan dengan alternatif rumus berikut
Contoh Soal dan Pembahasan Gas Ideal
1. Dalam sebuah ruangan terdapat 800 miligram gas dengan tekanan 1 atm. eKelajuan rata-rata partikel tersebut adalah750 m/s. Jika 1 atm = 105 N/m2 berapa volume ruangan tersebut?
Diketahui m = 800 mg = 8 x 10-4 Kg; p = 1 atm = 1 x 105 N/m2; v = 750 m/s
Ditanyakan V (volume) = ….. ?
Jawab :
Jawab :
dari rumus
1 (1) (8 x 10-4) (7,5 x 102)2
V= —————————————-
3 105
V = 1,5 x 10-3 m3
2. Suatu gas ideal mempunyai energi dalam 1,01 x 1028 joule. Jumlah mol gas tersebut bila besarnya energi kinetiknya 5 kJ adalah … mol
Diketahui U = 1,01 x 1028 J; Ek = 5 Kj = 5 x 103 J; No = 6,02 x 1023;
Ditanya n (jumlah mol) = ….?
Jawab :
U = NEk
1,01 x 1028 = N (5 x 103)
N = 1,01 x 1028 / (5 x 103)
N = 2,02 x 1024
jumlah mol = N/No = 2,02 x 1024 / 6,02 x 1023 = 3,35 mol
3. Suhu awal dari suatu gas dalam ruang tertutu adalah T. Tiap partikel bergerak secara acak dengan kelajuan 100 m/s. Kelajuan partikel saat suhu dinaikan menjadi 4T adalah?
Pembahasan dari rumus v2 = 3 kT/m bisa dilihat bahwa besarnya kecepatan berbanding lurus dengan akar dari suhunya
v ≈ √T
dapat sobat lihat bahwa v sebanding dengan aka T jika suhu dinaikkan 4 kali maka kecepatan akan naik sebanyak 2 kali (akar dari 4)
4. Sepuluh liter gas ideal suhunya 127oC punya tekanan 165,6 N/m2. Coba sobat hitung tentukan berapa banyaknya partikel dalam gas tersebut?
T = 127o C + 273 = 400 K
p = 165,6 N/m2
V = 10 liter = 10-2 m3
k = 1,38 x 10-23 J/K
pV = N kT ⇒ N = pV/ kT = 165,6 x 10-2 / (1,38 x 10-23 x 400) = 3 x 1020
sumber : http://rumushitung.com/2013/12/04/gas-ideal-rumus-dan-serba-serbinya/#








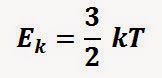

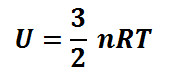


Tidak ada komentar:
Posting Komentar